Parmi les connaissances courantes sur le cancer gastrique précoce, certains points relatifs à cette maladie plus rare nécessitent une attention et un apprentissage particuliers. C'est le cas du cancer gastrique HP-négatif. Le terme « tumeurs épithéliales non infectées » est aujourd'hui plus répandu. La dénomination de ce cancer fait débat. Cette théorie s'appuie principalement sur les articles de la revue « Estomac et Intestin », qui utilise également l'appellation « cancer gastrique HP-négatif ».
Ce type de lésions se caractérise par une faible incidence, une identification difficile, des connaissances théoriques complexes et l'inapplicabilité de la méthode MESDA-G simplifiée. L'acquisition de ces connaissances implique de surmonter ces difficultés.
1. Connaissances de base sur le cancer gastrique HP-négatif
Histoire
On pensait autrefois que l'infection à Helicobacter pylori (HP) était la seule cause de l'apparition et du développement du cancer gastrique. Le modèle classique de cancérisation était donc le suivant : HP – atrophie – métaplasie intestinale – tumeur de bas grade – tumeur de haut grade – cancérisation. Ce modèle a toujours été largement reconnu, accepté et fermement ancré dans les croyances. Les tumeurs se développent sur un fond d'atrophie et sous l'action d'HP ; les cancers se développent donc principalement dans les zones atrophiées du tube digestif et moins fréquemment dans la muqueuse gastrique normale non atrophiée.
Par la suite, certains médecins ont découvert que le cancer de l'estomac pouvait survenir même en l'absence d'infection à Helicobacter pylori (HP). Bien que très rare, ce type de cancer est appelé cancer de l'estomac HP-négatif.
Avec la compréhension progressive de ce type de maladie, des observations et des synthèses systématiques et approfondies ont été entreprises, et la terminologie évolue constamment. On trouve ainsi un article de 2012 intitulé « Cancer gastrique après stérilisation », un autre de 2014 intitulé « Cancer gastrique HP-négatif » et un dernier de 2020 intitulé « Tumeurs épithéliales non infectées par Hp ». Cette évolution de la terminologie témoigne d'une compréhension plus approfondie et plus complète.
Types de glandes et modes de croissance
L'estomac contient deux principaux types de glandes fundiques et de glandes pyloriques :
Les glandes fundiques (ou glandes oxyntiques) sont réparties dans le fundus, le corps, les angles, etc. de l'estomac. Ce sont des glandes tubulaires linéaires et simples. Elles sont composées de cellules muqueuses, de cellules principales, de cellules pariétales et de cellules endocrines, chacune ayant ses propres fonctions. Parmi elles, les cellules principales sécrètent la PGI et présentent une coloration positive au MUC6, tandis que les cellules pariétales sécrètent de l'acide chlorhydrique et du facteur intrinsèque.
Les glandes pyloriques sont situées dans l'antre gastrique et sont composées de cellules à mucus et de cellules endocrines. Les cellules à mucus expriment la MUC6, et les cellules endocrines comprennent les cellules G, D et les cellules entérochromaffines. Les cellules G sécrètent la gastrine, les cellules D la somatostatine et les cellules entérochromaffines la sérotonine (5-HT).
Les cellules normales de la muqueuse gastrique et les cellules tumorales sécrètent différents types de mucus, classés en mucus « gastriques », « intestinaux » et « mixtes ». L'expression des mucines gastriques et intestinales constitue un phénotype et ne correspond pas à la localisation anatomique précise de l'estomac et des intestins.
Il existe quatre phénotypes cellulaires de tumeurs gastriques : complètement gastriques, mixtes à prédominance gastrique, mixtes à prédominance intestinale et complètement intestinaux. Les tumeurs issues d’une métaplasie intestinale présentent majoritairement un phénotype mixte gastro-intestinal. Les cancers différenciés présentent principalement un phénotype intestinal (MUC2+), tandis que les cancers diffus présentent principalement un phénotype gastrique (MUC5AC+, MUC6+).
Le diagnostic de cancer gastrique HP-négatif nécessite une combinaison spécifique de plusieurs méthodes de détection pour une analyse complète. Le cancer gastrique HP-négatif et le cancer gastrique post-stérilisation sont deux concepts distincts. Pour plus d'informations sur les manifestations radiologiques du cancer gastrique HP-négatif, veuillez consulter la section correspondante de la revue « Estomac et Intestin ».
2. Manifestations endoscopiques du cancer gastrique HP-négatif
Le diagnostic endoscopique est essentiel dans le cas du cancer gastrique HP-négatif. Il comprend principalement le cancer gastrique de type glandulaire fundique, le cancer gastrique de type muqueux glandulaire fundique, l'adénome gastrique, la tumeur épithéliale fovéolaire framboisée, le carcinome à cellules en bague à chaton, etc. Cet article porte sur les manifestations endoscopiques du cancer gastrique HP-négatif.
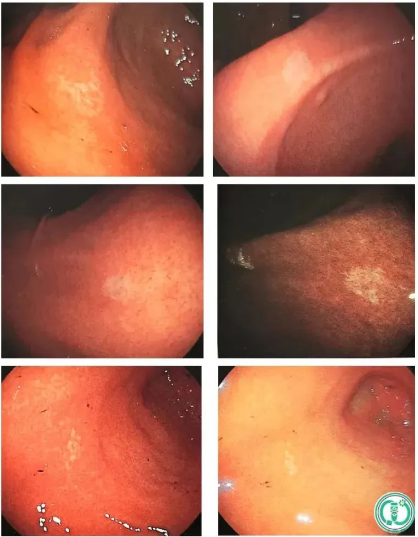
1) Cancer gastrique de type glande fundique
-Lésions blanches surélevées
cancer gastrique de type glande fundique
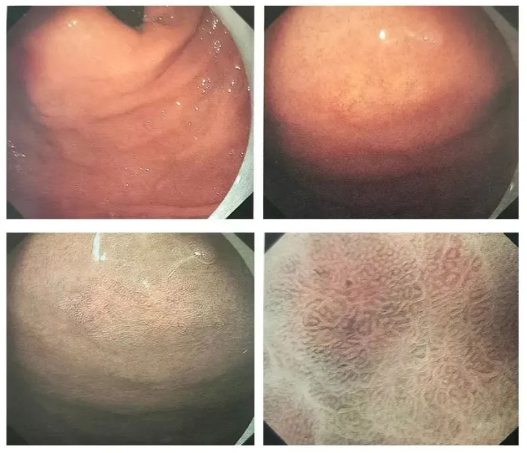
◆Cas 1 : Lésions blanches et surélevées
Description:Fornix fundique gastrique – grande courbure du cardia, 10 mm, blanc, type O-lia (aspect SMT), sans atrophie ni métaplasie intestinale en arrière-plan. Présence de vaisseaux sanguins arborisés en surface (NBI et légère dilatation).
Diagnostic (associé à l'anatomopathologie) :U, O-1la, 9 mm, cancer gastrique de type glande fundique, pT1b/SM2 (600 μm), ULO, Ly0, VO, HMO, VMO
-Lésions blanches plates
cancer gastrique de type glande fundique
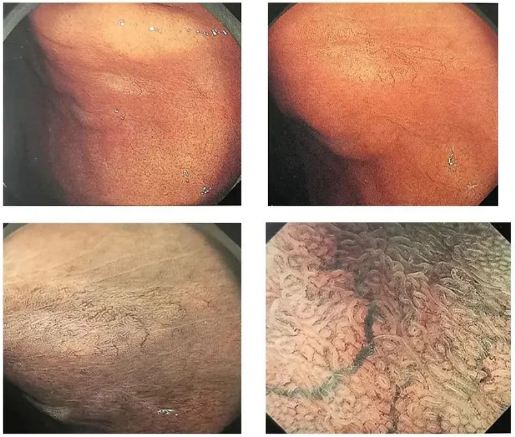
◆Cas 2 : Lésions blanches, plates/déprimées
Description:Paroi antérieure du fornix-cardia du fundus gastrique, grande courbure, 14 mm, blanche, type 0-1lc, sans atrophie ni métaplasie intestinale en arrière-plan, contours flous, vaisseaux sanguins dendritiques visibles en surface. (NBI et amplification abrégées)
Diagnostic (associé à l'anatomopathologie) :U, 0-Ilc, 14 mm, cancer gastrique de type glande fundique, pT1b/SM2 (700 μm), ULO, Ly0, VO, HMO, VMO
-Lésions rouges surélevées
cancer gastrique de type glande fundique
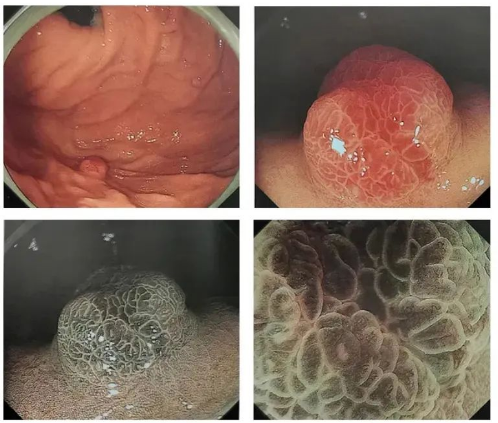
◆Cas 3 : Lésions rouges et surélevées
Description:La paroi antérieure de la grande courbure du cardia mesure 12 mm, est nettement rouge, de type 0-1, sans atrophie ni métaplasie intestinale en arrière-plan, avec des contours nets et des vaisseaux sanguins dendritiques en surface (NBI et légère dilatation).
Diagnostic (associé à l'anatomopathologie) :U, 0-1, 12 mm, cancer gastrique de type glande fundique, pT1b/SM1 (200 μm), ULO, LyO, VO, HMO, VMO
-Lésion rouge, plate et déprimées
cancer gastrique de type glande fundique
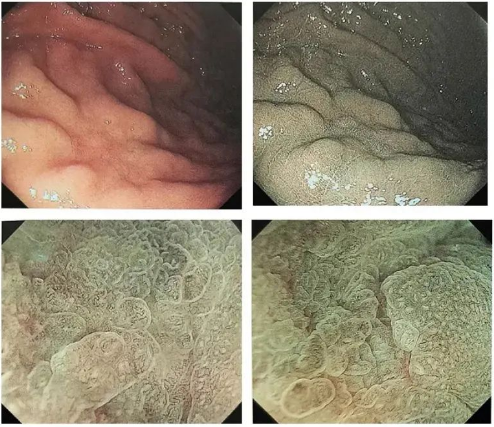
◆Cas 4 : Lésions rouges, plates/déprimées
Description:Paroi postérieure de la grande courbure de la partie supérieure du corps gastrique, 18 mm, rouge clair, type O-1Ic, sans atrophie ni métaplasie intestinale en arrière-plan, limite floue, sans vaisseaux sanguins dendritiques en surface, (NBI et élargissement omis)
Diagnostic (associé à l'anatomopathologie) :U, O-1lc, 19 mm, cancer gastrique de type glande fundique, pT1b/SM1 (400 μm), ULO, LyO, VO, HMO, VMO
discuter
Les hommes atteints de cette maladie sont plus âgés que les femmes, avec un âge moyen de 67,7 ans. En raison de la simultanéité et de l'hétérochronie de son apparition, les patients chez qui un cancer gastrique de type fundique a été diagnostiqué doivent être suivis annuellement. La localisation la plus fréquente est la région fundique, située dans la partie moyenne et supérieure de l'estomac (le fundus et la partie moyenne et supérieure du corps gastrique). Les lésions surélevées, de type SMT (tumeur sous-muqueuse superficielle), sont plus fréquentes en lumière blanche. Le traitement principal est la résection endoscopique de la muqueuse (EMR) ou la dissection sous-muqueuse endoscopique (ESD) à visée diagnostique.
Aucune métastase lymphatique ni invasion vasculaire n'a été observée à ce jour. Après le traitement, il convient de déterminer la nécessité d'une intervention chirurgicale complémentaire et d'évaluer la corrélation entre le caractère malin et la présence d'HP. Tous les cancers gastriques de type glandulaire fundique ne sont pas HP négatifs.
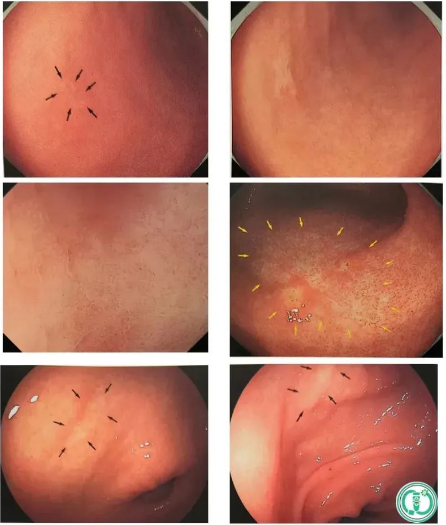
1) Cancer gastrique de la muqueuse des glandes fundiques
cancer gastrique de la muqueuse des glandes fundiques
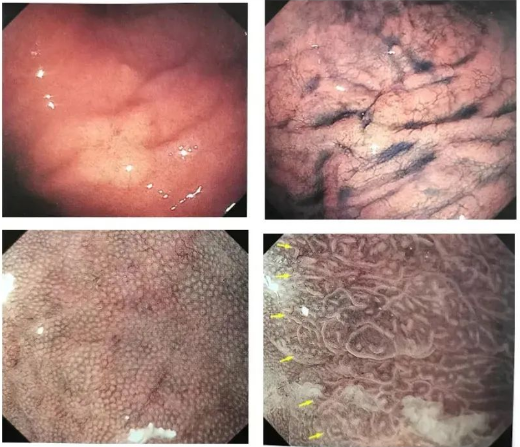
◆Cas 1
Description:La lésion est légèrement surélevée et une muqueuse gastrique non atrophique (RAC) est visible autour. Une microstructure et des microvaisseaux en évolution rapide sont observés dans la partie surélevée de la lésion (ME-NBI), et une DL est visible.
Diagnostic (associé à l'anatomopathologie) :Cancer gastrique de la muqueuse des glandes fundiques, zone U, 0-1la, 47*32mm, pT1a/SM1 (400μm), ULO, Ly0, VO, HMO, VMO
cancer gastrique de la muqueuse des glandes fundiques
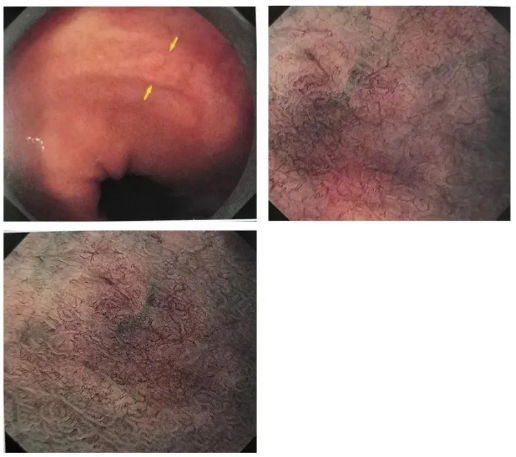
◆Cas 2
Description: Lésion plane sur la paroi antérieure de la petite courbure du cardia, avec une décoloration et une rougeur mixtes, des vaisseaux sanguins dendritiques sont visibles à la surface, et la lésion est légèrement surélevée.
Diagnostic (associé à l'anatomopathologie): Cancer gastrique de la muqueuse des glandes fundiques, 0-lla, pT1a/M, ULO, LyOV0,HM0,VMO
discuter
Le nom « adénocarcinome de la muqueuse des glandes gastriques » est complexe et son incidence est très faible. Son diagnostic et sa compréhension nécessitent un effort particulier. L’adénocarcinome de la muqueuse des glandes fundiques présente un caractère hautement malin.
L'endoscopie en lumière blanche présente quatre caractéristiques principales : ① lésions homochromatiques délavées ; ② tumeur sous-épithéliale SMT ; ③ vaisseaux sanguins dendritiques dilatés ; ④ microparticules régionales. Performances de l'endoscopie multiphotonique (ME) : DL(+)IMVP(+)IMSP(+)MCE élargit l'IP et augmente la résolution. En utilisant le processus recommandé par le MESDA-G, 90 % des cancers gastriques de la muqueuse des glandes fundiques répondent aux critères diagnostiques.
3) Adénome gastrique (adénome de la glande pylorique PGA)
adénome gastrique
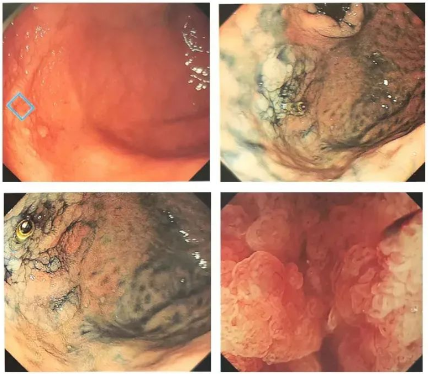
◆Cas 1
Description:Une lésion blanche, plane et surélevée, aux contours mal définis, a été observée sur la paroi postérieure du fornix gastrique. La coloration au carmin d'indigo n'a pas révélé de limites nettes, et l'aspect du gros intestin (légèrement dilaté) était similaire à celui d'une lésion de type LST-G.
Diagnostic (associé à l'anatomopathologie) :Carcinome à faible atypie, O-1la, 47 × 32 mm, adénocarcinome tubulaire bien différencié, pT1a/M, ULO, Ly0, VO, HMO, VMO
adénome gastrique
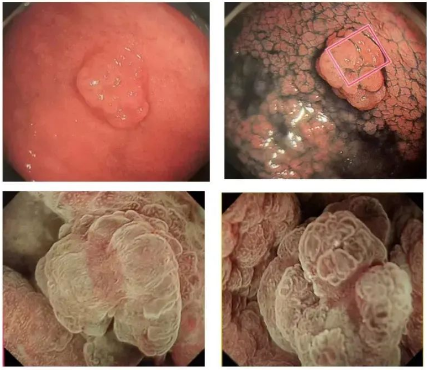
◆Cas 2
DescriptionLésion surélevée avec nodules sur la paroi antérieure de la partie moyenne du corps gastrique. Une gastrite active est visible en arrière-plan. La bordure est marquée par le carmin d'indigo. (NBI et léger grossissement)
PathologieL'expression de MUC5AC et de MUC6 a été observée dans l'épithélium superficiel. Le diagnostic final était un PGA.
discuter
Les adénomes gastriques sont essentiellement des glandes mucineuses infiltrant le stroma et recouvertes d'un épithélium fovéolaire. Du fait de la prolifération de protrusions glandulaires hémisphériques ou nodulaires, les adénomes gastriques visualisés en lumière blanche endoscopique apparaissent tous nodulaires et protubérants. Il est important de prêter attention aux quatre classifications de Jiu Ming lors de l'examen endoscopique. L'imagerie ME-NBI permet d'observer l'aspect papillaire/villeux caractéristique des adénomes gastriques primitifs (AGP). Les AGP ne sont pas systématiquement négatifs pour Helicobacter pylori ni non atrophiques, et présentent un risque de transformation maligne. Un diagnostic et un traitement précoces sont recommandés. Après le diagnostic, une résection en bloc et des examens complémentaires approfondis sont préconisés.
4) (aspect de framboise) cancer gastrique épithélial fovéolaire
cancer gastrique épithélial fovéolaire à la framboise
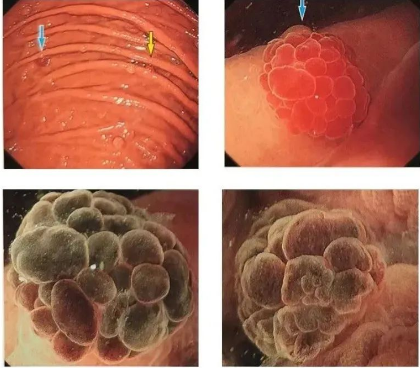
◆Cas 2
Description:(omis)
Diagnostic (associé à l'anatomopathologie): cancer gastrique épithélial fovéolaire
cancer gastrique épithélial fovéolaire à la framboise
◆Cas 3
Description:(omis)
Diagnostic (associé à l'anatomopathologie) :cancer gastrique épithélial fovéolaire
discuter
La framboise, appelée « Tuobai'er » dans notre région natale, était un fruit sauvage qui poussait au bord des routes quand nous étions enfants. L'épithélium glandulaire et les glandes sont liés, mais leur contenu est différent. Il est essentiel de comprendre les caractéristiques de croissance et de développement des cellules épithéliales. Le carcinome épithélial gastrique de type « framboise » ressemble beaucoup aux polypes gastriques et peut facilement être confondu avec eux. La caractéristique principale de l'épithélium fovéolaire est l'expression dominante de MUC5AC. C'est pourquoi le terme générique pour ce type de carcinome est « carcinome épithélial fovéolaire ». Il peut se développer en présence ou en absence d'HP, ou après stérilisation. Aspect endoscopique : une protubérance ronde, rouge vif, ressemblant à une fraise, généralement à contours nets.
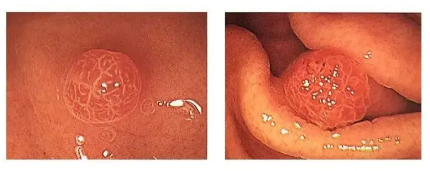
5) Carcinome à cellules en bague à chaton
Carcinome à cellules en bague à chaton : aspect en lumière blanche
Carcinome à cellules en bague à chaton : aspect en lumière blanche
carcinome à cellules en bague à chaton
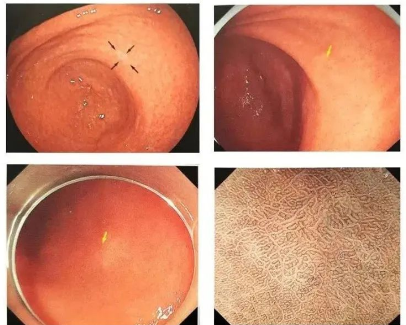
◆Cas 1
Description:Lésion plane sur la paroi postérieure du vestibule gastrique, 10 mm, estompée, type O-1Ib, sans atrophie du fond, bordure visible initialement, bordure non évidente lors du réexamen, ME-NBI : seule la partie interfovéale devient blanche, IMVP(-)IMSP (-)
Diagnostic (associé à l'anatomopathologie) :Les prélèvements ESD sont utilisés pour diagnostiquer le carcinome à cellules en bague à chaton.
Manifestations pathologiques
Le carcinome à cellules en bague à chaton est le type le plus malin. Selon la classification de Lauren, le carcinome gastrique à cellules en bague à chaton est classé comme un carcinome diffus et indifférencié. Il se développe généralement dans le corps de l'estomac et se présente le plus souvent sous forme de lésions planes ou enfoncées, avec des colorations irrégulières. Les lésions surélevées sont relativement rares et peuvent également se manifester par des érosions ou des ulcères. Il est difficile à détecter lors d'un examen endoscopique à un stade précoce. Le traitement peut consister en une résection curative, telle qu'une dissection endoscopique sous-muqueuse (DES), avec un suivi postopératoire rigoureux et une évaluation de la nécessité d'une intervention chirurgicale complémentaire. Une résection non curative nécessite une intervention chirurgicale complémentaire, dont la technique est choisie par le chirurgien.
Le texte, la théorie et les images ci-dessus proviennent de « Estomac et Intestin ».
En outre, il convient également de prêter attention au cancer de la jonction œsogastrique, au cancer du cardia et à l'adénocarcinome bien différencié trouvé sur un fond HP-négatif.
3. Résumé
Aujourd'hui, j'ai appris les connaissances pertinentes et les manifestations endoscopiques du cancer gastrique HP-négatif. Cela inclut principalement : le cancer gastrique de type glandulaire fundique, le cancer gastrique de type muqueux glandulaire fundique, l'adénome gastrique, la tumeur épithéliale fovéolaire (en forme de framboise) et le carcinome à cellules en bague à chaton.
L'incidence clinique du cancer gastrique HP-négatif est faible, son diagnostic difficile et le risque d'erreur diagnostique élevé. Les manifestations endoscopiques de cette maladie rare et complexe sont encore plus difficiles à appréhender. Une compréhension endoscopique, notamment des connaissances théoriques sous-jacentes, est donc essentielle.
En présence de polypes gastriques, d'érosions et de zones rouges et blanches, il convient d'envisager la possibilité d'un cancer gastrique Helicobacter pylori négatif. Le diagnostic de cancer gastrique Helicobacter pylori négatif doit être posé selon des critères précis, et il faut être vigilant face aux faux négatifs dus à une confiance excessive dans les résultats du test respiratoire. Les endoscopistes expérimentés privilégient l'examen clinique. Face à la complexité de la théorie du cancer gastrique Helicobacter pylori négatif, il est essentiel de poursuivre nos études, notre compréhension et notre pratique afin de la maîtriser.
Nous, Jiangxi Zhuoruihua Medical Instrument Co., Ltd., sommes un fabricant chinois spécialisé dans les consommables endoscopiques, tels que :pinces à biopsie, clip hémostatique, piège à polypes, aiguille de sclérothérapie, cathéter à pulvérisation, brosses de cytologie,fil guide,panier de récupération des calculs, cathéter de drainage biliaire nasal, etc.. qui sont largement utilisés dansDME,ESD,CPRE.Nos produits sont certifiés CE et nos usines sont certifiées ISO. Nos marchandises sont exportées en Europe, en Amérique du Nord, au Moyen-Orient et dans certaines régions d'Asie, et sont largement reconnues et appréciées par nos clients.
Date de publication : 12 juillet 2024


